Die Lichtsinneszellen der Säugetier-Retina: Anpassungen an Lebensräume und Lebensweisen?
Forschungsbericht (importiert) 2009 - Max-Planck-Institut für Hirnforschung
Lichtsinneszellen: Zapfen und Stäbchen
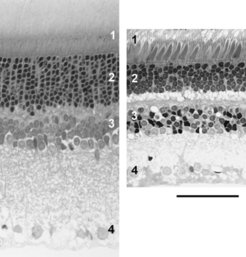
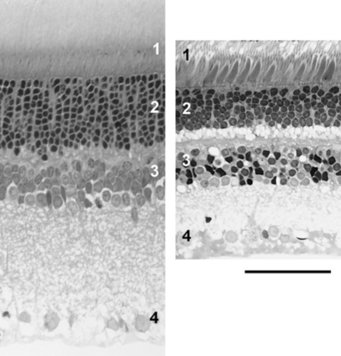
Die Lichtsinneszellen (Fotorezeptoren) bilden die Eingangsstufe der retinalen Bildverarbeitung. Sie wandeln Lichtreize in neuronale Signale um und führen diese den nachgeschalteten Nervenzellen der Retina zu (Abb. 1). Nur was sie an Lichtreizen aufnehmen, kann von Retina und Gehirn zu einem Seheindruck weiterverarbeitet werden. Alle Säugetiere besitzen zwei Klassen von Lichtsinneszellen, die Zapfen und die Stäbchen. Die Stäbchen sind für das Dämmerungs- und Nachtsehen zuständig, die Zapfen für das Sehen bei Tageslicht und für das Farbensehen. Als Anpassung an ihre Lebensweise besitzen nachtaktive Säuger sehr viele Stäbchen und nur einen geringen Zapfenanteil von 0,5 bis 3 %, während tagaktive Säuger weniger Stäbchen und einen höheren Zapfenanteil von 8 bis 95 % aufweisen (Abb. 2), [1].
Interessanterweise gibt es bei den Säugetieren keine reinen Stäbchen- oder Zapfenretinae, auch die nachtaktivsten Arten haben einige Zapfen und die tagaktivsten einige Stäbchen. Hier erlaubt der Bauplan offenbar keine Ausnahmen. Zum Farbensehen werden mehrere Zapfentypen mit unterschiedlicher spektraler Empfindlichkeit benötigt. Durch Vergleich der Signale dieser Zapfentypen können nachgeschaltete Retina-Zellen die Farbe eines Reizes berechnen. Die spektrale Empfindlichkeit wird durch das jeweilige Sehpigment (Opsin) bestimmt, das ein Zapfen enthält. Bei Nacht, wenn nur mit den Stäbchen gesehen wird, ist keine Farbwahrnehmung möglich, da alle Stäbchen dasselbe Sehpigment enthalten.
Farbenblinde Säugetiere?

Wir Menschen und die anderen Altwelt-Primaten haben drei spektrale Zapfentypen, Blau-, Grün- und Rotzapfen, die uns „trichromatisches“ Farbensehen ermöglichen. Jede von uns wahrgenommene Farbe lässt sich in drei Primärfarben zerlegen, sie entspricht der relativen Anregung der drei Zapfentypen. Die Nicht-Primaten unter den Säugetieren wurden lange Zeit für farbenblind gehalten, und man findet diese Ansicht noch heute in manchen populärwissenschaftlichen Texten. Die Forschung hat jedoch inzwischen gezeigt, dass die meisten Säuger Blauzapfen und Grünzapfen besitzen und damit zu „dichromatischem“ Farbensehen befähigt sind, welches in etwa der Farbwahrnehmung eines rot-grün-blinden Menschen entspricht (Abb. 2A-C), [2; 3]. Man nennt diese Zapfen und ihre Opsine allgemein kurzwellig empfindliche oder S-Zapfen und S-Opsine (engl. shortwave sensitive), beziehungsweise langwellig empfindliche oder L-Zapfen und L-Opsine (engl. longwave sensitive). Unsere Rotzapfen sind eine Neuerung, die erst bei der Evolution der Altwelt-Primaten durch Verdoppelung des L-Opsin-Gens entstand. Hund, Katze, Pferd und Rind, ja sogar Ratte und Maus können also Farben sehen, allerdings weniger reichhaltig und abgestuft als wir. Ihnen erscheinen alle Farben im langwelligen Bereich des Spektrums (grün, gelb, orange, rot) gleich, da sie nur einen Zapfentyp dafür haben.
Nur wenige Säugetiere sind wirklich farbenblind, da sie nur Grünzapfen besitzen und die Blauzapfen völlig verloren haben [1]. Mit einem Zapfentyp allein können sie keine Farben sehen (wie das auch bei unserem Nachtsehen mit dem einen Stäbchentyp der Fall ist). Die meisten dieser Arten sind nachtaktiv, und man kann vermuten, dass Farbensehen in ihrer lichtarmen Umgebung eine entbehrliche Leistung war. Leo Peichl und sein Team waren deshalb sehr überrascht, als sie bei Walen und Robben nirgendwo Blauzapfen fanden (Abb. 2D), [4]. Bei der Evolution dieser Meeressäuger aus landlebenden Vorfahren, die Blauzapfen besaßen, ist es offenbar durch konvergente Evolution zum generellen Blauzapfenverlust gekommen. Dies erscheint paradox, da blaue Lichtanteile in klarem Meerwasser am tiefsten eindringen. Auch wenn Farbensehen in einer monochrom blauen Unterwasserwelt keine Rolle spielt, so wären dort doch die Blauzapfen am besten zur Wahrnehmung von Helligkeiten und Kontrasten geeignet. Es ist also rätselhaft, warum ausgerechnet sie aufgegeben wurden.
Ultraviolett-Sehen
Das Sehpigment (Opsin) unserer Blauzapfen stammt evolutionär vom ultraviolett-empfindlichen S-Opsin der Reptilien ab und hat sich bei den meisten Säugetieren ins Blaue verschoben. Allerdings haben die Untersuchungen mehrerer Forschergruppen gezeigt, dass einige Beuteltiere und Nagetiere (zum Beispiel Mäuse und Ratten) die ursprüngliche UV-Empfindlichkeit des S-Opsins beibehalten haben. Sie können also für uns unsichtbares UV-Licht wahrnehmen. Als Grund für die Verschiebung des S-Opsins bei den meisten Säugern wird angenommen, dass das zellschädigende UV-Licht durch Gelbfärbung der Linse ausgefiltert wird und nicht zu den Photorezeptoren gelangt. Daraufhin habe sich die Empfindlichkeit des S-Opsins zum noch verfügbaren Blau verschoben. Bei nachtaktiven Nagern, deren Augen wegen der geringen Lichtintensitäten keiner hohen UV-Belastung ausgesetzt sind, habe es keinen Druck zur Ausfilterung des UV-Anteils gegeben und sie hätten die ursprüngliche UV-Empfindlichkeit beibehalten können. Die Wissenschaftler am MPI für Hirnforschung fanden jedoch, dass auch beim tagaktiven Degu, einem Meerschweinchen-Verwandten, die S-Zapfen UV-empfindlich sind, und postulieren deshalb einen adaptiven Vorteil des UV-Sehens, der das Risiko erhöhter zellulärer UV-Belastung wert ist [5]. Vermutlich können die Tiere damit den stark UV-reflektierenden Urin, den sie ausgiebig zur Markierung ihres Territoriums einsetzen, nicht nur riechen, sondern auch sehen.
Auch beim Maulwurf und bei Fledermäusen zeigte sich, dass die S-Zapfen nicht blau-, sondern UV-empfindlich sind. Das Team um Peichl fand bei Maulwurf und Fledermäusen sowohl L- als auch S-Zapfen und damit die Möglichkeit zu dichromatischem Farbensehen, das auch den UV-Bereich einschließt [6; 7]. Damit ist nachgewiesen, dass UV-Sehen nicht auf Nagetiere und Beuteltiere beschränkt ist, sondern auch bei weiteren Säugerordnungen (Insektivoren und Chiropteren) vorkommt. Bei den sehr nachtaktiven Fledermäusen war lange Zeit umstritten, ob sie überhaupt Zapfen oder nur Stäbchen besitzen. Die Befunde bestätigen die Grundregel, dass auch sehr nachtaktive Säuger Zapfen besitzen.
Unterirdisch lebende Säugetiere
Im Laufe der Evolution haben fast 300 Säugetierarten eine unterirdische (subterrane) Lebensweise angenommen. Subterrane Arten gibt es in mehreren Ordnungen (Nager, Insektivoren, Beuteltiere), die Anpassungen geschahen also mehrfach unabhängig. Viele dieser Arten verbringen ihr ganzes Leben im Untergrund, wo sie nach Wurzeln und Knollen graben, sich fortpfanzen und ihre Jungen aufziehen; Ausflüge an die Oberfläche und Kontakte mit Licht sind selten und zufällig. Es wird allgemein angenommen, dass dieses lichtlose Leben zu einer konvergenten Rückbildung der Augen und des Sehsystems geführt hat, wie z. B. beim Blindmull mit seinen unter verwachsenen Lidern liegenden Miniaturaugen.
Die Augen anderer subterraner Arten sind allerdings größer und offen, sie sprechen für ein weniger zurückgebildetes Sehvermögen. Die Forscher am Frankfurter MPI haben die Retinae und vor allem die Fotorezeptoraustattung bei mehreren subterranen Säugern untersucht. Sie erwarteten, dass sie als Anpassung an das – wenn überhaupt vorhandene – schwache Licht ihres Lebensraumes besonders hohe Stäbchendichten und besonders geringe Zapfendichten besitzen würden. Genau das Gegenteil war der Fall. Alle untersuchten Nager-Arten, von den afrikanischen Sandgräbern Graumull, Riesengraumull und Nacktmull bis zu den südamerikanischen Trugratten Cururo und Tukotuko, zeigten sehr viel geringere Stäbchendichten und deutlich höhere Zapfenanteile (etwa 10 %) als nachtaktive oberirdisch lebende Säuger (Abb. 2), [8]. Das gleiche gilt für den Maulwurf, einen Insektivoren [6]. Auch die subterranen Arten haben die säugertypischen L- und S-Zapfen, allerdings mit artspezifischen Unterschieden: Bei den Sandgräbern dominieren die S-Zapfen, bei den Trugratten die L-Zapfen. Bei Trugratten und Maulwurf sind die S-Zapfen UV-empfindlich. Diese Befunde widersprechen der Lehrmeinung, dass die Sehsysteme der subterranen Säuger generell degeneriert sind, und sprechen für artspezifisch unterschiedliche Anpassungen. Die Wissenschaftler vermuten, dass in lichtloser Umgebung auch noch so zahlreiche und empfindliche Stäbchen kein Sehen ermöglichen würden und deshalb nichts in ihre Optimierung investiert wurde, ja, sie sogar reduziert wurden, um Energie zu sparen. Die Zapfen hingegen wurden beibehalten, um bei gelegentlichen Oberflächenaktivitäten zur visuellen Orientierung und Feindvermeidung beizutragen.
Stäbchenkerne als Mini-Linsen
Säugetiere haben wie alle Wirbeltiere eine ‚invertierte‘ Retina, bei der die Fotorezeptoren auf der lichtabgewandten Seite liegen. Das Licht muss erst die ganze Dicke der Retina durchdringen, um auf die lichtempfindlichen äußeren Teile der Fotorezeptoren zu stoßen. Dies stellt die nachtaktiven Säugetiere vor ein Problem. Ihre Retinae haben sehr hohe Stäbchendichten zur Detektion des schwachen Lichts – aber dadurch enthält die Retina mehr Zellen, ist dicker und verliert durch Streuung mehr Licht , bevor dieses die Sehpigmente der Fotorezeptoren erreicht (Abb. 1 links). In Zusammenarbeit mit Zellbiologen der Ludwig-Maximilians-Universität München und Physikern der Universität Cambridge konnten die Max-Planck-Wissenschaftler zeigen, wie dieses Problem bei der Evolution der Säugetiere gelöst wurde: Der nächtliche Lebensstil und dessen visuelle Herausforderungen haben sich in den Stäbchen bis in die Organisation der Zellkerne ausgewirkt [9].
Bei allen Körperzellen ist der lange DNA-Strang von speziellen Proteinen umkleidet und der so gebildete Chromatinfaden kunstvoll aufgewickelt, um in den nur wenige Mikrometer großen Zellkern zu passen. Chromatin bildet im Kern zwei prinzipielle Bereiche, Euchromatin und Heterochromatin. Das Euchromatin enthält die Gene, die transkribiert werden, um neue Proteine zu bilden. Es ist weniger eng gepackt und damit besser für die Transkription zugänglich. Das dichter gepackte Heterochromatin enthält die nicht transkribierten DNA-Abschnitte. Das Euchromatin befindet sich typischerweise in inneren Bereichen des Zellkerns, während ein großer Teil des Heterochromatins an der Peripherie des Zellkerns liegt. Diese konventionelle Architektur findet sich in den Zellkernen fast aller Organismen, sie ist das Erfolgsmodell der Evolution.

Zu ihrer Überraschung beobachteten die Forscher bei der Analyse von fast 40 Säugerarten in den Stäbchenkernen aller nachtaktiven Arten eine genau umgekehrte Anordnung des Chromatins: Das Heterochromatin ist hier im Inneren des Zellkerns zusammengeballt, während das Euchromatin an der Peripherie liegt. Die Stäbchenkerne aller tagaktiven Spezies waren dagegen konventionell organisiert (Abb. 3), [9]. Nach Ausschluss einer Reihe von alternativen Erklärungen blieb nur noch die Interpretation, dass die invertierte Kernarchitektur dem nächtlichen Sehen dient. Es erwies sich, dass das dichtere Heterochromatin einen höheren optischen Brechungsindex als das Euchromatin hat und die invertierten Stäbchenkerne als Sammellinsen fungieren, die das eintreffende Licht bündeln (Abb. 3). Da die frühen Säuger nachtaktiv waren, schließen die Forscher, dass die invertierte Kernarchitektur am Anfang der Säugerevolution entstand und dass später tagaktiv gewordene Säugergruppen jeweils wieder zur konventionellen Architektur zurückkehrten. Die Stäbchenkerne der Säuger sind ein eindrucksvolles Beispiel dafür, wie die natürliche Selektion eine jeweils optimale Lösung für unterschiedliche Anforderungen findet.