Von der Evolution lernen: Kortikale Funktion, Dynamik von Hirnverschaltungen und Schlaf bei Reptilien
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Hirnforschung
Wissenschaftler am MPI für Hirnforschung arbeiten daran, die Regeln der Informationsverarbeitung im Gehirn mit Hilfe einfacherer Systeme und Modellorganismen experimentell zu entschlüsseln. Dabei konzentrieren sie sich hauptsächlich auf die Informationsverarbeitung in der Hirnrinde (Kortex). Neben Säugetieren besitzen nur Reptilien einen geschichteten Kortex, der bei ihnen allerdings deutlich einfacher aufgebaut ist. Die Gruppe von Gilles Laurent untersucht den visuellen Kortex, die kortikale Dynamik – Aktivitätswellen und Oszillationen – sowie den Schlaf von Schildkröten und Bartagamen.
Trotz erheblicher Anstrengungen über mehr als ein Jahrhundert hinweg und trotz des bemerkenswerten technischen Fortschritts der letzten Jahrzehnte, ist man noch weit davon entfernt, die Informationsverarbeitung im Säugetier-Kortex und in damit verwandten Strukturen zu verstehen. Mit seinen sechs Schichten, seiner modularen Architektur, kanonischen Verschaltungen und Netzwerken [1], unzähligen Zelltypen [2] und der Komplexität der Informationsverarbeitung [3], bleibt das Verständnis des Isocortex (6-schichtiger Säugetierkortex oder Neokortex) doch eine rätselhafte, große Herausforderung.
Der Isokortex hat sich höchstwahrscheinlich aus einfacheren, geschichteten Verschaltungen im Vorderhirn von Vorfahren moderner Amnioten (Tiere mit einer Embyonalhülle) entwickelt. Diese Strukturen finden wir noch heute bei Säugetieren, wie beispielsweise im Paleo- und Archikortex (piriformer Kortex bzw. Hippokampus-Formation), zusammen mit ein paar "Übergangs"-Bereichen mit weniger Schichten [4].
Unter den dreischichtigen Kortizes stellt der piriforme Säugetierkortex (PCx) ein gutes Modellsystem dar, um an ihm die Funktion, Dynamik und Informationsverarbeitung kortikaler Schaltkreise zu untersuchen. Das Erforschen der Funktion des piriformen Kortex, der der Verarbeitung von Geruchsreizen dient, stellt sich als sehr schwierig dar. Dies liegt an der sehr großen Menge an möglichen Geruchsreizen, die durch Mischung von vielen Einzelkomponenten entstehen, und dem Fehlen einer klaren Messbarkeit der Psychophysik des Riechens [5].
Einfache Kortizes existieren aber nicht nur im olfaktorischen System. Bei Reptilien setzt sich der gesamte zerebrale Kortex aus nur drei Schichten zusammen und einige Areale sind primäre sensorische Bereiche. Der visuelle Kortex der Wasserschildkröte (dorsaler Kortex, DCx) und der piriforme Kortex im Säugetier (PCx) liegen auf sehr ähnlichen Positionen entlang ihrer jeweiligen sensorischen Bahnen. Zwischen dem jeweiligen Sinnesorgan (Auge, Nase) und der kortikalen Verarbeitungsstation existiert in beiden Fällen nur eine einzige Umschaltstation im Zwischenhirn (lateraler Kniehöcker, Riechkolben). Unser gegenwärtiges Verständnis der sensorischen Signalverarbeitung im visuellen Kortex der Wasserschildkröte ist noch begrenzt, aber dieses Modellsystem hat einen bemerkenswerten Vorteil: sein sensorischer Eingang kann im Vergleich zum Riechsystem erheblich leichter kontrolliert stimuliert werden.
Der Ansatz von Gilles Laurent und seinem Team liegt darin, diese einfacheren Modellsysteme zu nutzen, um ein algorithmisches Verständnis der Hirnfunktionen zu erhalten. Reptilien (einschließlich Vögeln) und Säugetiere bilden die Gruppe der Amnioten, die sich aus einem gemeinsamen Vorfahren vor ca. 320 Millionen Jahren entwickelt haben. Bei der Erforschung des Reptilienkortex untersuchen die Wissenschaftler somit die Funktion des Hirnbereichs in unseren Vorfahren, aus dem sich alle vorhandenen Kortizes (vom 3-schichtigen zum 6-schichtigen) entwickelt haben.
Der visuelle Kortex der Wasserschildkröte unterscheidet sich signifikant vom Säugetierkortex
Wasserschildkröten besitzen einen echten visuellen Kortex mit indirekten Input-Projektionen von der Retina über den sog. Nucleus geniculatus lateralis. Diese Projektionen enden jedoch ausschließlich in der oberflächlichen Schicht 1 des Kortex (im Gegensatz hierzu enden diese Projektionen im primären visuellen Kortex der Säugetiere hauptsächlich in Schicht 4), und projizieren in einer verteilten, nicht räumlich geordneten Weise in den gesamten visuellen Kortex. Entsprechend weisen die erregenden Nervenzellen im visuellen Kortex der Wasserschildkröte sehr große visuelle rezeptive Felder auf, die sich über 120x90 Grad des Sehraumes erstrecken (Abb. 1).
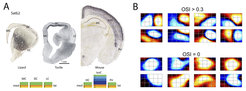
Diese rezeptiven Felder unterscheiden sich auch signifikant von ihren Pendants im Säugetier: Es fehlen ihnen – mit einigen Ausnahmen – die klaren, lokal benachbarten AN- und AUS-Subfelder, bei denen Erregung (AN) und Hemmung (AUS) der Zellen durch Reizung benachbarter Orte in der Außenwelt ausgelöst werden. Derartige Zelleigenschaften sind charakteristisch für die V1-Neuronen der Schicht 4 bei Nagern, Katzen und Primaten. Der visuelle Kortex der Reptilien scheint sich somit grundsätzlich von der entsprechenden Struktur bei Säugetieren zu unterscheiden. Er verfügt offensichtlich über keine geordnete Abbildung des Sehraumes (Retinotopie) und andere funktionelle Karten, die einer räumlich geordneten Anordnung von Antworteigenschaften (z. B. Orientierungsselektivität oder Okulardominanz) entsprechen, die bei Säugetieren über Jahrzehnte untersucht wurden. Vielmehr erinnert der visuelle Kortex der Reptilien an die olfaktorischen und hippokampalen Kortizes im Säugetier, an Strukturen also, von denen man weiß, dass sie beliebigen Merkmal-Assoziationen zu Grunde liegen (von chemischen Analyten für den olfaktorischen Kortex, bzw. navigationsbezogenen Merkmalen für den Hippocampus).
Die Wissenschaftler um Laurent versuchen derzeit, die funktionale Logik dieses visuellen Kortex in Reptilien zu verstehen, die auf faszinierende Weise die in der Retina und im Thalamus enthaltene räumliche Information zu verwerfen scheint. Könnte der visuelle Kortex der Wasserschildkröte der Vorfahre der Hippocampus-Bildung im Säugetier (und somit enger mit ihm verwandt) sein, und könnte er somit Informationen zu Positionen und Relationen extrahieren, die für die Navigation nützlich sind, anstatt visuelle Szenen in ihre Formbestandteile zu zerlegen? Derzeit versucht das Labor, diese Fragen zu beantworten [6].
Parallele Ableitungen vom Schildkrötenkortex in vitro
Charakteristisch für Reptilien im Allgemeinen und Schildkröten im Besonderen ist die Tatsache, dass sie wechselwarm sind (im Gegensatz zu Vögeln und Säugetieren, die Warmblüter sind) und bei reduzierter Sauerstoffzufuhr überleben können. Wasserschildkröten beispielsweise können für Stunden bis Wochen ohne zu atmen unter Wasser überleben. Diese Eigenschaft wurde von Neurobiologen als besonders vorteilhaft für In-Vitro-Studien identifiziert: Das intakte Gehirn einer Wasserschildkröte kann tatsächlich über 48 Stunden hinweg in einer Gewebekulturschale aufbewahrt werden, ohne dass es signifikanten Schaden oder Aktivitätsverlust erleidet.

Daten von Mike Hemberger und Mark Shein-Idelson.
Die Forscher haben sich diese Eigenschaft zunutze gemacht und einen Versuchsaufbau entwickelt, bei dem die ventrikuläre Oberfläche direkt auf sog. high-density-Mikroelektroden-Arrays (MEAs) aufgebracht wird (Abb. 2), um so die Aktivität hunderter von Neuronen gleichzeitig aufzuzeichnen. Dabei beobachteten sie, dass auch die postsynaptische Wirkung einzelner Neuronen von den Arrays erfasst werden konnte. Diese einfache Tatsache bietet mindestens zwei bemerkenswerte Vorteile: Zum einen erlaubt sie, einzelne Neuronen zweifelsfrei als exzitatorisch oder inhibitorisch zu klassifizieren. Zum anderen ermöglicht sie, die physische Ausdehnung von Axonkollateralen (bestimmten Seitenästen der Nervenfaser) zu verfolgen, solange sie innerhalb eines Abstands von etwa 100 µm von den MEA-Elektroden verlaufen. Wenn man diese Analyse parallel mit hunderten gleichzeitig abgeleiteter Neuronen durchführt, kann man eine funktionale und physikalische Beschreibung der verteilten Verbindungen generieren, ohne auf Bildgebung oder optische Aufzeichnungen zurückgreifen zu müssen. Die MPIler wenden diese Techniken an, um ein mechanistisches Verständnis der visuellen Schaltkreise zu gewinnen.
Evolution des Schlafes
Es ist allgemein anerkannt, dass die meisten Tiere – von wirbellosen Tieren bis zum Menschen – "schlafen". Die wichtigsten Attribute des Schlafes, die von allen Tieren geteilt werden, betreffen Verhalten, Sensorik, Motorik, Physiologie und Homöostase; zusammen genommen definieren sie, was häufig als "Verhaltensschlaf" beschrieben wird und leicht bei Insekten, Fischen oder Säugetieren beobachtet werden kann. Die ersten elektrophysiologischen Untersuchungen des Schlafes wurden beim Menschen durchgeführt und ergaben klare elektroenzephalographische (EEG-) Korrelate der Schlafzustände im Gehirn. Forscher unterteilen jetzt die Schlaf-EEGs von Säugetieren in zwei Haupttypen: (i) Der sog. „Slow Wave“-Schlaf (SWS) ist in seiner tiefsten Form durch hohe spektrale Energie bei niedrigen Frequenzen (<4 Hz oder "delta") gekennzeichnet und ist im frühen Stadium des Schlafes häufig von wiederkehrenden 7-14Hz-Oszillationen begleitet, auch als "Spindeln" bekannt. (ii) Der Nicht-SW- oder REM-Schlaf (REMS), mit EEG-Mustern, die den im Wachzustand beobachteten ähneln (bei Katzen und Menschen zunächst als "desynchronisiert" bezeichnet, enthalten diese Muster oft Energie in Gamma-, Beta- oder Theta-Bändern - wie bei Nagern). Dieser Schlaf wird von markanten schnellen Augenbewegungen (REM) und einer ansonsten gelähmten axialen Muskulatur und Muskulatur der Extremitäten begleitet. Diese elektrophysiologischen Attribute des Schlafes sind bisher nur bei Säugetieren und Vögeln (Nicht-Vogel-Reptilien ausgenommen) nachgewiesen worden. Da Säugetiere und Vögel Warmblüter sind, während Nicht-Vogel-Reptilien wechselwarm sind, wurde die Entwicklung von REM- und SW-Schlaf als Resultat der Bedürfnisse von Warmblütern betrachtet und als Ergebnis der evolutionären Konvergenz interpretiert. Man ging also davon aus, dass diese Merkmale im Verlauf der Stammesgeschichte unabhängig voneinander entstanden sind.

Abb. 3: Die australische Eidechse Pogona vitticeps weist Säugetier-ähnlichen REM- und Nicht-REM-Schlaf auf, entgegen der bisherigen Auffassung, dass elektrographischer Schlaf auf Vögel und Säugetiere beschränkt ist. A) Kladogramm von amnioten Wirbeltieren, das eine gemeinsame Abstammung nahelegt (gemäß den heute verfügbaren Daten). In pink: Vögel und Säugetiere, von denen man glaubte, sie seien die einzigen Tierarten, die REM- und SW-Schlaf aufweisen. MYA: vor Millionen von Jahren. B) Der Nachtschlaf im Leben einer Eidechse. Das Licht wird um 19:00 Uhr für 12 Stunden ausgeschaltet. Dargestellt ist das Verhältnis des spektralen Energiegehaltes in den Delta- und Beta-Bändern (jeweils 0-4 Hz und 10-30 Hz) (siehe Farbtabelle) im lokalen Feldpotenzial, das im DVR des Vorderhirns aufgezeichnet wurde. Jede Zeile steht für 30 Minuten Daten. Beachten Sie, dass kurz nachdem das Licht ausgeschaltet wurde, ein periodischer Wechsel zwischen hohem Delta/Beta (SWS) und geringem Delta/Beta auftrat. Die niedrige Delta-Phase entspricht dem REM-Schlaf. Daten von Mark Shein, Janie Ondracek, Huah-Peng Liaw und Sam Reiter.
Bei dem Versuch, die Funktion des Reptilien-Kortex zu verstehen, führt die Abteilung von Laurent chronische Ableitungen vom Gehirn mittelgroßer Echsen durch, den Bartagamen (Pogona vitticeps). Während sich die ersten Versuche auf wache, sich normal verhaltende Tiere konzentrierten, begannen die Wissenschaftler dann auch, die Hirnaktivität während der Nacht aufzuzeichnen. Zu ihrer Überraschung konnten sie beobachten, dass das Gehirn der Bartagame während des Verhaltensschlafes (gekennzeichnet durch Immobilität, geschlossene Augen und reduzierte Herzfrequenz) in einen oszillatorischen Modus zwischen zwei Zuständen wechselte. Der eine Zustand glich dem SW-Schlaf der Säugetiere mit langsamer (Delta-) Aktivität. Der zweite Modus glich dem REM-Schlaf inklusive rascher Augenbewegung im Wechsel mit dem Slow-Wave-Schlaf. Während der Nacht wechselten diese beiden Zustände mit einer Zyklusdauer von ca. 60 bis 80 Sekunden hin und her (Abb. 3). Über die gesamte Nacht hinweg durchlief das Hirn also 250 bis 350 Schlafzyklen (Menschen durchlaufen nur vier bis fünf Zyklen mit einer Dauer von je 90 Minuten). Die feinen elektrophysiologischen Merkmale dieser Aktivität ähneln denen, die bei Nagetieren während des Schlafes im Hippokampus aufgezeichnet wurden. Jedoch stammen sie aus einem Bereich des Gehirns, der nicht äquivalent mit dem Hippocampus der Eidechse ist, sondern mit einem Bereich des Reptiliengehirns, dessen Säugetierhomolog (vorausgesetzt, es gibt eines) unter vergleichenden Neurobiologen für Streit sorgt.
Diese Ergebnisse verändern demnach unsere Sicht auf die evolutionäre Entwicklung des Schlafes. REM- und SW-Schlaf sind vermutlich uralte dynamische Eigenschaften der Hirnaktivität während der Ruhe- bzw. Schlafphase, die sich vor mehr als 300 Millionen Jahren entwickelt haben, wenn nicht noch früher. Somit sind REM- und SW-Schlaf nicht das Resultat evolutionärer Konvergenz, die an Warmblüter gekoppelt ist. Einige der dynamischen Parameter, die SW- und REM-Schlaf charakterisieren, scheinen sich jedoch geändert zu haben (z. B. die Dauer der Schlafzyklen), während andere stabil blieben (z. B. sharp waves und high frequency ripples). Die Wissenschaftler am MPI für Hirnforschung beginnen nun, einige der mechanistischen Aspekte der Schlafregulierung zu untersuchen, wobei sie ihre Entdeckung bezüglich des Reptilienschlafes berücksichtigen.
Literaturhinweise
Edited by Shepherd, G.M., Grillner, S.
Oxford University Press (2010)
In: Handbook of Brain Microcircuits, 15-21
Edited by Shepherd, G.M., Grillner, S.
New York: Oxford University Press (2010)
Edited by Kepes, F.
World Scientific (2006)


