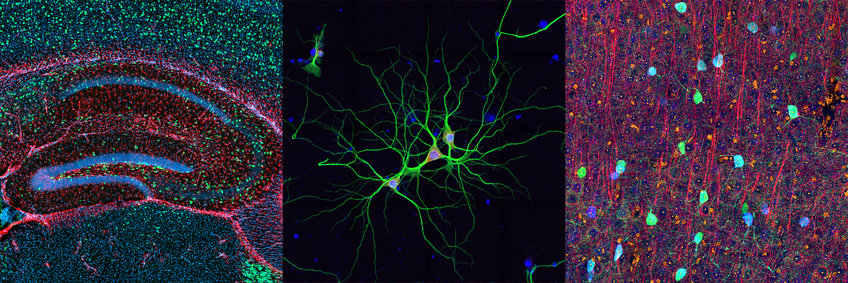
Abteilung für Synaptische Plastizität
Erin Schuman
Das langjährige Forschungsinteresse des Labors von Erin Schuman gilt der Erforschung der zellularen Mechanismen und neuronalen Schaltkreise, die der Informationsverarbeitung und -speicherung zugrunde liegen. Das Labor konzentriert sich dabei auf die molekularen und zellbiologischen Prozesse, die den Proteinaufbau und -abbau in den Nervenzellen und deren Synapsen bestimmen. Die komplexe Struktur der Nervenzellen, bei der sich die meisten Synapsen hunderte von Mikrometern vom Zellkörper entfernt befinden, stellt eine logistische Herausforderung für die Herstellung, den Erhalt und die Veränderung der lokalen synaptischen Proteome dar. Nervenzellen haben dieses Problem gelöst, indem sie wichtige zellbiologische Maschinen einschließlich der Ribosomen und Proteasomen in den Dendriten und Axonen lokalisieren.
Nachdem ihrem Labor im Jahr 1996 erstmals die Entdeckung gelang, dass für synaptische Plastizität Proteine erforderlich sind, die lokal in Dendriten hergestellt werden, sind sie der Identifizierung des mRNA- und Ribosom-Bestands in den neuronalen Dendriten und Axonen nachgegangen. Das Labor hat so tausende von mRNAs in Dendriten und Axonen entdeckt und die einzigartigen, bestimmenden Elemente, die sich in diesen mRNAs befinden, beschrieben.
Darüber hinaus beleuchten sie den Bestand an mRNAs, die in den subzellularen Kompartimenten translatiert werden, sowie die Erscheinungsform/Struktur und den Aufbau der vorhandenen Ribosomen. Um sich mit den oben aufgeführten Fragen zu befassen, haben sie Plattformen entwickelt, mit Hilfe derer sie neu hergestellte Proteine in Nervenzellen und anderen Zellen kennzeichnen, reinigen, bestimmen und visualisieren können. Hierzu benutzen sie “non-canonical amino acid metabolic labelling”, Click-Chemie, und Mutationen zellbiologischer Enzyme (die BONCAT- und FUNCAT-Techniken). Derzeit liegt der Schwerpunkt des Labors auf der Erscheinungsform und der Spezialisierung von mRNA, Proteinaufbau- und Proteinabbaumaschinen sowie Proteinaufbau- und Proteinabbaumechanismen in Nervenzellen. Das Labor setzt darüber hinaus Zebrafische als Modellsystem ein, um die molekularen und zellulären Grundlagen sozialen Verhaltens zu erforschen.
- Vielfalt an Transkriptomen in Dendriten, Axonen und Synapsen
- Vielfalt an Proteomen in Dendriten, Axonen und Synapsen
- Struktur der neuronalen Ribosome und Translationsmaschinen
- Einfluss der Vielfalt an Transkriptomen und Proteomen auf die Struktur und Funktion
- Proteinabbaumaschinen und die Rückkopplungsmechanismen mit der Proteinsynthese
- Molekulare und zelluläre Grundlagen sozialen Verhaltens
Frühe Beiträge und Geschichte des Schuman-Labors
Synapsen, die Kontaktpunkte zwischen Nervenzellen, können hunderte von Mikrometern weit entfernt vom Zellkörper auftreten. Die Stärke der synaptischen Kommunikation wird bestimmt und reguliert von Proteinen, die die Synapsen bewohnen. Wenn man bedenkt, wie weit die Synapsen vom Zellkörper entfernt sind, fragt man sich, wie sie an die Proteine gelangen, die sie benötigen, um zu funktionieren (ca. 550.000 Proteine pro Nervenzelle pro Minute). Das Schuman-Labor hat den ersten Beweis erbracht, dass Proteine, die lokal und nah bei den Synapsen hergestellt werden, verwendet werden können, um die synaptische Kommunikation, die dem Gedächtnis auf Zellebene entspricht, zu verbessern. Diese frühen Arbeiten und die nachfolgenden Forschungen und technischen Beiträge ihres Teams haben einen großen Einfluss darauf gehabt, das Feld der lokalen Translation zu begründen, zu erweitern und zu festigen.
In den ersten Experimenten, die Erin als Assistant Professor zusammen mit ihrem ersten Doktoranden, Hyejin Kang, durchgeführt hat, zeigte sie, dass der Wachstumsfaktor BDNF langanhaltende synaptische Plastizität erzeugen kann, welche eine Übereinstimmung zum Gedächtnis auf Zellebene ist (Kang & Schuman, Science, 1995). In einer weiteren Veröffentlichung nur ein Jahr später (Kang and Schuman, Science, 1996) fanden sie heraus, dass diese Plastizität lokale Proteinsynthese erfordert. Diese Beobachtung eröffnete das Feld der lokalen Translation und zeigte direkt, dass lokale Translation wichtig für die synaptische Funktion ist. Diese Veröffentlichung zusammen mit Arbeiten von Kelsey Martin (und Eric Kandel), Christine Holt und anderen war eine treibende Kraft für die Erforschung der lokalen Translation in Entwicklung und Plastizität, die in der Folge entstanden ist. In den 1980er Jahren dokumentierten Steward und Kollegen mittels Elektronenmikrofotografie die Anwesenheit von Polyribosomen nahe bei Synapsen. Diese bedeutende Beobachtung erhielt ohne eine funktionale Rolle für die lokale Translation nicht so viel Zugkraft, wie sie es verdient hätte. Lokale Translation ist nicht nur ein fundamentaler zellbiologischer Prozess für die normale Funktion von Nervenzellen, sondern sie hat sich auch als zentral für viele neuronale Entwicklungsstörungen erwiesen, darunter Fragile X und einige Autismus-Spektrum-Störungen.
Über einen Zeitraum von 25 Jahren hat das Schuman-Labor zu der sich entwickelnden Bedeutsamkeit von lokaler Translation beigetragen. So haben zum Beispiel im Jahr 2001 die Doktoranden Girish Aakalu, Bryan Smith und Kollegen die Proteinsynthese, die in Dendriten stattfindet, direkt sichtbar gemacht. Sie benutzten ein dendritisch zielgerichtetes und GFP-basiertes Reportergen bei gleichzeitiger physischer Isolation des Dendriten und machten so zum ersten Mal Proteinsynthese in lebenden Dendriten sichtbar. Dies war die erste überzeugende Darstellung und Visualisierung der dendritischen Proteinsynthese und dieser Ansatz wird inzwischen von vielen Laboren verwendet. Weiterhin zeigte das Labor die kritische Bedeutung der lokalen Translation in vielen Zusammenhängen einschließlich deren Rolle bei der synaptischen Homeostase (Science, 2004; Cell, 2006; Neuron, 2008) sowie deren nachgeschaltete Rolle bei der Dopaminrezeptorsignalisierung (Neuron, 2005). In einer jüngeren Studie (Neuron, 2012) verwendete das Schuman-Team RNA-Sequenzierung, um über 2500 mRNAs in Dendriten zu bestimmen, was darauf hinweist, dass lokale Translation synaptischer Proteine weiterverbreitet ist als zuvor angenommen. Diese ersten Sequenzierungsstudien sind durch die Arbeit vieler anderer Labore und durch spätere Arbeiten im Schuman-Labor ergänzt worden (siehe hierzu jüngere Veröffentlichungen aus dem Labor von Tushev, Glock, Perez, Biever, Hafner und Donlin-Asp).
Ein wichtiger Grund, warum sich die Idee einer lokalen mRNA-Translation nur langsam formte, mögen die fehlenden Techniken gewesen sein, um sich mit Proteinen in lebenden Zellen zu befassen und sie zu identifizieren. Auch hier hat das Schuman-Labor Beiträge geleistet. Um die Proteintranslation zu erforschen, muss man die neu hergestellten Proteine in den Zellen genau bestimmen und sichtbar machen können. Angeführt durch die Arbeit der Postdoktorandin Daniela Dieterich erfand das Schuman-Team zusammen mit ihrem Kollegen Dave Tirrell (Chemie, Caltech) eine Methode, die künstliche Aminosäuren und Click-Chemie verwendet, um neu synthetisierte Proteine zu kennzeichnen. Diese Technologie ermöglicht es Wissenschaftlern, neu synthetisierte Proteine in jeder Zelle, jedem Gewebe oder jedem Organ zu markieren und zu bestimmen (PNAS, 2006). In weiteren Arbeiten (Nature Neurosci., 2010; Nature Methods 2015) entwickelte das Labor eine Variante dieser Technologie, die es möglich macht, neu synthetisierte Proteine in situ sichtbar zu machen. In einer jüngeren Veröffentlichung (Nature Biotech, 2017), die von der Postdoktorandin Beatriz Alvarez-Castelao vorangetrieben wurde, hat das Labor nun neu synthetisierte Proteine aus einzelnen Zelltypen gekennzeichnet und bestimmt und so der gesamten Sammlung an Technologien eine genetisch kodierbare und zelltypspezifische Kontrolle ermöglicht. Diese Plattform kann dazu verwendet werden, Proteine zu identifizieren, die Zellveränderungen unter normalen und erkrankten Bedingungen antreiben, und ihr Team sowie Kollegen haben Technologieplattformen für Würmer, Fliegen, Fische und Mäuse erschaffen.




