Neuroblastom: Entstehung eines Tumors im Kindesalter
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Hirnforschung
Proliferationskontrolle in unterschiedlichen Bereichen des sich entwickelnden Nervensystems
Die Proliferation neuraler Vorläuferzellen, die anschließend zu Nervenzellen differenzieren, wird als Neurogenese bezeichnet. Die Anzahl der Nervenzellen, die während der Neurogenese entstehen, ist durch die Anzahl der Vorläuferzellen und das Verhältnis von im Zellzyklus verbleibenden und von den Zellzyklus verlassenden neuronalen Zellen bestimmt.
Für das embryonale Großhirn wurde während der frühen Neurogenese eine symmetrische Zellteilung von Vorläuferzellen beschrieben, gefolgt von asymmetrischer Zellteilung, die jeweils eine Vorläuferzelle und ein postmitotisches Neuron produziert. Das Ende der Neurogenese ist durch symmetrische Zellteilungen charakterisiert, in denen zwei Neuronen entstehen und die Vorläuferzellen damit verbraucht werden. Dieses Neurogenese-Prinzip, bei dem neuronale Differenzierung eng an das Verlassen des Zellzyklus gekoppelt ist, gilt auch für das periphere Nervensystem mit Ausnahme der sympathischen Ganglien.
In sympathischen Ganglien liegt ein stark modifizierter Neurogenese-Mechanismus vor (Abb. 1).
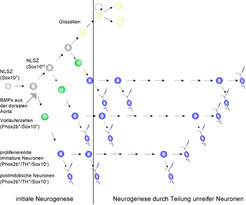
Undifferenzierte, teilungsaktive Vorläuferzellen sind nur während der initialen Neurogenese-Phase vorhanden. Ihre Tochterzellen differenzieren zu Neuronen, die jedoch nicht den Zellzyklus verlassen, sondern sich weiter teilen. Somit entstehen die postmitotischen sympathischen Neuronen vorwiegend aus sich teilenden, jedoch bereits differenzierten Neuronen, die im Folgenden als unreife Neuronen bezeichnet werden [1, 2, 3].
Molekulare Kontrolle der Neurogenese in sympathischen Ganglien
Die initiale Differenzierung sympathischer Neuronen, die der Neurogenese vorausgeht, wird durch ein genregulatorisches Netzwerk gesteuert, zu dem die Transkriptionsfaktoren Phox2b, Ascl1, Insm1, AP-2b, Hand2 und Gata2/3 gehören [4, 3]. Neuere Untersuchungen haben gezeigt, dass diese Faktoren auch in späteren Entwicklungsstadien exprimiert werden und wichtige Funktionen ausüben. So wurde nach Ausschaltung von Phox2b, Ascl1, AP-2b, Hand2, Gata3, Insm1 und Sox11 eine stark reduzierte Proliferation unreifer sympathischer Neurone beobachtet [5, 3]. Umgekehrt führt die Überexpression von Hand2, Insm1 und Gata2/3 zu einem Anstieg der Proliferation. Für Phox2b wurde jedoch nach Überexpression eine verringerte Proliferation beobachtet [6]. Phox2b ist demnach einerseits für die Proliferation erforderlich, bei hohen Phox2b-Konzentrationen, wie sie bei Überexpressionsversuchen erreicht werden, wirkt Phox2b jedoch antiproliferativ. Neuronale Differenzierung und Neurogenese, d.h. die Vermehrung unreifer sympathischer Neuronen wird somit durch dieselbe Gruppe von Transkriptionsregulatoren gesteuert.
Neben den intrazellulären Proliferationsregulatoren spielen extrazelluläre Wachstumsfaktoren ebenfalls eine wichtige Rolle, wie für IGF-I, Wnts und Midkine (Mk) gezeigt wurde. Midkine ist ein Ligand des Tyrosinkinase-Rezeptors Anaplastic-Lymphoma-Kinase (Alk).
Unter den bislang identifizierten Proliferationsregulatoren befinden sich zwei Gene, Phox2b und Alk, die an der Entstehung von Neuroblastomen beteiligt sind. Dies war der Anlass, neben der normalen Funktion dieser Proteine auch die Effekte von mutierten Varianten zu untersuchen, die bei diesen Tumoren entdeckt worden waren.
Das Neuroblastom entsteht ausschließlich aus neuronalen Zellen des sympathischen Nervensystems, die sich aus bisher nur ansatzweise geklärter Ursache ungehindert vermehren. Mit ca. 7-8 Prozent aller Tumorneubildungen ist das NB die zweithäufigste Krebserkrankung in der frühen Kindheit. Nach heutigem Wissensstand gibt es keine wirkungsvolle Therapie für die aggressiven Formen des NB [7].
Bei Phox2b und Alk handelt es sich um die bislang einzigen Gene, deren Mutationen mit der Entstehung von NB einhergehen, d.h. zu einer sogenannten NB-Prädisposition führen [8, 9]. Es war deshalb wichtig, die Funktion der mutierten Phox2b- und Alk-Proteine in unreifen sympathischen Neuronen zu untersuchen, also in den Zellen, aus denen der Tumor entsteht. Für Alk ergab sich außerdem die Frage nach der normalen physiologischen Funktion in sympathischen Ganglien.
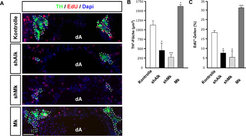
Welche Konsequenzen haben die Phox2b- und Alk-Mutationen auf die Entwicklung sympathischer Nervenzellen?
Alk und Mk werden in der Neurogenese-Phase in sympathischen Neuronen exprimiert und sind für die normale Proliferation erforderlich, wie durch Ausschaltung des Alk-Signalwegs gezeigt wurde [10], (Abb. 2). Die starke Abnahme der Midkine-Expression am Ende der Neurogenese lässt vermuten, dass die Beendigung der Proliferation durch eine reduzierte Aktivität des Alk-Signalwegs verursacht wird. Die Überexpression von Alk und Midkine führt zu einer erhöhten Proliferation und Gangliengröße, noch stärkere Proliferationseffekte wurden durch Überexpression von mutierten Alk-Rezeptoren beobachtet, die Liganden-unabhängig permanent aktiv sind [10].
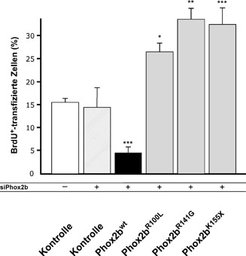
Interessanterweise führt die Stimulierung des Alk-Rezeptors zur Expression des Proto-Onkogens NMyc, das direkt Einfluss auf die Zellzyklusregulation nimmt. Die durch Mk/Alk verursachte NB-Prädisposition kann somit durch eine gestörte Proliferationskontrolle und die Induktion von NMyc erklärt werden [10]. Mk/Alk werden in parasympathischen Ganglien nicht oder nur in sehr geringen Mengen exprimiert, was auf eine spezifische Funktion in der Proliferationskontrolle sympathischer Neuronen hinweist und mit klinischen Befunden korreliert, nach denen die Entstehung von NB auf das sympathische Nervensystem beschränkt ist.
Eine Erhöhung der Phox2b-Expression in unreifen sympathischen Neuronen führt in vivo und in vitro zu einer starken Proliferationshemmung. Die in NB beobachteten Phox2b-Varianten mit Mutationen in der sog. Homöo-Domäne haben nicht nur die anti-proliferative Tumorsuppressor-Funktion verloren, sondern bewirken eine im Vergleich zur Kontrolle erhöhte Proliferation [6], (Abb. 3). Obwohl die Verknüpfung der Phox2b-Funktion mit der Zellzyklusregulation noch weitgehend unklar ist, führen Mutationen in Phox2b und Alk zu einer erhöhten und vermutlich verlängerten Proliferationsphase und erhöhen so die Wahrscheinlichkeit zusätzlicher Mutationen, die für die Entstehung von NB vermutlich erforderlich sind.
Entwicklungsbiologische Grundlagenforschung liefert somit nicht nur neue Erkenntnisse zur Neurogenese im autonomen Nervensystem, sondern trägt außerdem zum besseren Verständnis der Mechanismen bei, welche der Entstehung von Neuroblastomen zugrunde liegen.


