Regulation der Signalübertragung an glutamatergen Synapsen in der Großhirnrinde
Forschungsbericht (importiert) 2004 - Max-Planck-Institut für Hirnforschung
Regulation synaptischer Übertragung durch präsynaptische elektrische Signalprozesse
Die zelluläre Neurowissenschaft hat große Fortschritte erzielt, einerseits beim Verständnis der Signalverarbeitungsprozesse in den dendritischen Ausläufern, die die Empfangsregionen der Nervenzellen darstellen, und andererseits im Verständnis des molekularen Apparates der Transmitterfreisetzung an Synapsen. Man geht im Allgemeinen davon aus, dass Signale an den Nervenfasern, den Axonen, in diskrete Impulse (Aktionspotenziale) übersetzt werden. Die Aktionspotenziale vermitteln die Kommunikation zwischen dem Zellkörper und den Synapsen entlang der Axone. Über eine zusätzliche Rolle unterschwelliger Membranpotenzialschwankungen zur Regulation synaptischer Übertragung, beispielsweise hervorgerufen durch axonale oder präsynaptische Rezeptoren, ist bisher wenig bekannt. Untersuchungen des präsynaptischen Membranpotenzials setzten einen unmittelbaren elektrischen Zugang voraus. In der Großhirnrinde kommt bisher für solche Studien nur ein Modellsystem in Frage, nämlich die Moosfaser-CA3-Pyramidenzellsynapse im Hippokampus, da hier die synaptischen Endigungen mit 3-5 µm Durchmesser relativ groß sind. Durch die Optimierung und Weiterentwicklung der Patch-Clamp-Technik in akuten Gehirnschnitten ist es möglich, direkte Ableitungen von den präsynaptischen Elementen der Moosfaser-CA3-Pyramidenzellsynapse vorzunehmen [1] [2]. Durch diesen methodischen Ansatz konnte Henrik Alle in der Nachwuchsgruppe zeigen, dass die elektrische Kommunikation zwischen dem Zellkörper und der Synapse nicht auf Aktionspotenziale beschränkt ist. Vielmehr werden unterschwellige Membranpotenzialschwankungen am Zellkörper in einer langsam abklingenden Weise fortgeleitet, sodass sie noch in präsynaptischen Endigungen, 1 mm vom Zellkörper entfernt, nachweisbar sind. Diese durch Fortleitung hervorgerufenen, präsynaptischen Membranpotenzialänderungen lösen für sich alleine keine Transmitterfreisetzung aus, aber sie modifizieren die durch ein Aktionspotenzial freigesetzte Transmittermenge. Es kommt zu einer Verstärkung der synaptischen Übertragung. Dies bedeutet, dass an der Moosfaser-CA3 Pyramidenzellsynapse ein neues Kodierungsprinzip gilt (Abb. 1). Die Vorgeschichte der unterschwelligen Änderungen des Membranpotenzials beeinflusst nun den Informationsgehalt der überschwelligen Impulse. Die Ausgangsinformation einer Nervenzelle ist nun nicht mehr ausschließlich durch Aktionspotenziale kodiert [3].
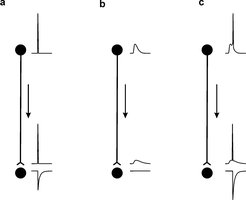
Der Befund einer weit reichenden, passiven axonalen Signalpropagation wirft die Frage auf, ob diese Signale im Axon oder im präsynaptischen Element weiter verarbeitet werden. Henrik Alle konnte direkt zeigen, dass GABAA-Rezeptoren in präsynaptischen Endigungen vorkommen und geeignet sind, durch Kurzschlussströme die propagierten Signale zu reduzieren. Diese präsynaptischen Rezeptoren können durch spezifische Interneurone aktiviert werden [4]. Somit findet elektrische Signalverarbeitung auf dem gesamten Weg von der Eingangssynapse einer Nervenzelle bis zur Ausgangssynapse statt.
Die Anwendbarkeit dieses neuen Kodierungsprinzips auf andere Synapsentypen in der Großhirnrinde muss noch untersucht werden. Sollte dieses Prinzip verbreitet sein, würde den in der Literatur beschriebenen Membranpotenzialoszillationen am Zellkörper von Projektionsneuronen eine völlig neue Funktion für die synaptische Regulation und damit für die Verarbeitungsleistung des Gehirns zugeordnet werden können [5]. Daraus ergeben sich direkte Konsequenzen für theoretische Konzepte der neuronalen Informationsverarbeitung.
Langzeitplastizität der Erregung GABAerger Interneurone
Den zweiten Schwerpunkt der Nachwuchsgruppe bildet das Studium der erregenden synaptischen Übertragung auf GABAerge Interneurone im Hippokampus und Neokortex. GABAerge Interneurone kontrollieren durch die hemmende Wirkung des Neurotransmitters GABA die Aktivität des Gesamtnetzwerkes. Über die Physiologie erregender synaptischer Transmission auf GABAerge Interneurone ist noch sehr wenig bekannt. Eine Schwierigkeit liegt in der erheblichen Diversität von Subtypen GABAerger Interneurone begründet. Deshalb konzentrieren wir uns auf einen Haupttypen, die Korbzelle. Dieser Zelltyp kontrolliert die Ausgangsaktivität der Projektionsneurone durch hemmende, perisomatische Synapsen.
Neurologische Erkrankungen wie Epilepsie, Dystonien und auch Schizophrenie werden mit Veränderungen bzw. Störungen in diesem spezifischen inhibitorischen Schaltkreis in Verbindung gebracht. Bisher wurde in der Literatur davon ausgegangen, dass glutamaterge Synapsen auf Korbzellen keine Langzeitpotenzierung aufweisen können und vielmehr eine statische Netzwerkkomponente darstellen. Dies liegt daran, dass molekulare Mechanismen, die für die Langzeitplastizität an Projektionsneuronsynapsen notwendig sind, in diesen Interneuronen nicht ausgeprägt werden [6].
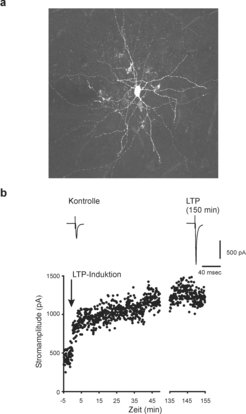
In der Vergangenheit konnten wir jedoch zeigen, dass langanhaltende Veränderungen der Transmissionsstärke an erregenden Synapsen auf Korbzellen im Gyrus dentatus vorkommen [7]. Frank Tennigkeit in der Nachwuchsgruppe ist es nun gelungen, Langzeitpotenzierung an erregenden Synapsen auf Korbzellen im Neokortex von adulten Nagern nachzuweisen und damit zu zeigen, dass es sich hierbei um eine generelle Eigenschaft der glutamatergen Erregung von Korbzellen in der Großhirnrinde handelt. Diese neue Form der kortikalen Plastizität kann mindestens zweieinhalb Stunden anhalten. In Zusammenarbeit mit Takaichi Fukuda von der Universität Kyushu in Japan konnte ein großer Teil der Zellen anhand morphologischer und immunhistochemischer Analysen zweifelsfrei als Korbzellen identifiziert werden (Abb. 2). Es gibt Hinweise darauf, dass diese Form von Plastizität im adulten Tier sogar stärker ausgeprägt ist als am jungen Tier [8].
Insgesamt erlauben diese Befunde nun, das vorherrschende Paradigma der fehlenden Interneuronplastizität zu überwinden und den Weg für die Aufklärung der Interneuron-spezifischen molekularen Mechanismen dieser Form der neuronalen Plastizität frei zu machen. Diese Mechanismen sind mögliche Ansatzpunkte für Neuropharmaka, die selektiv bestimmte Interneuron-Schaltkreise beeinflussen und in der Therapie neurologischer Erkrankungen eingesetzt werden könnten.

