Glyzin, ein hemmender Neurotransmitter in der Netzhaut
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für Hirnforschung
Einführung
Die Netzhaut (Retina) ist 0,2 Millimeter dick und kleidet die Innenfläche des Auges aus. Sie ist beim Menschen etwas größer als eine Zwei-Euro-Münze und enthält 120 Millionen Nervenzellen. Fällt ein Lichtreiz auf die Netzhaut (in Abb. 1A von unten), wird er von den Photorezeptoren, den Zapfen und Stäbchen, in ein elektrisches Signal verwandelt. Dieses Signal wird an Kontaktstellen (Synapsen) auf die Bipolar- und Horizontalzellen übertragen. Von den Bipolarzellen wird das Signal an die Ganglien- und Amakrinzellen weitergeleitet. Komplexe neuronale Verschaltungen zwischen Bipolar-, Amakrin- und Ganglienzellen verarbeiten den Lichtreiz und filtern bestimmte Mustermerkmale, wie zum Beispiel Farbe, Kontrast oder Bewegung, heraus, die dann von den Ganglienzellen im optischen Nerv zum Gehirn gesendet werden. Die Verarbeitung der Lichtsignale in der Netzhaut erfolgt durch 50 unterschiedliche Typen von Nervenzellen, die sowohl erregende als auch hemmende Schaltkreise bilden [1]. Der vorliegende Bericht behandelt die Schaltkreise und Synapsen, an denen der Transmitter Glyzin freigesetzt wird.
Glyzinerge Amakrinzellen
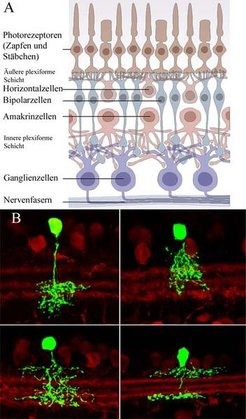
Glyzin ist neben GABA (Gamma-Amino- Buttersäure) der wichtigste hemmende Transmitter in der Netzhaut. GABA-erge Amakrinzellen haben in der Regel weit verzweigte Fortsätze (Dendriten). Glyzinerge Amakrinzellen bilden kleine Dendritenbäume aus und verzweigen sich in vertikaler Richtung. Unterschiedliche Typen von glyzinergen Amakrinzellen sind in Abbildung 1B zu sehen. Diese Zellen wurden in der Netzhaut einer transgenen Maus untersucht, wo sie auf gentechnischem Wege mit grün fluoreszierendem Protein (GFP) beladen wurden [2]. Es gibt vermutlich insgesamt 15 unterschiedliche Typen glyzinerger Amakrinzellen. Sie bilden synaptische Verbindungen mit Bipolarzellen, Ganglienzellen und anderen Amakrinzellen aus.
Glyzinrezeptoren
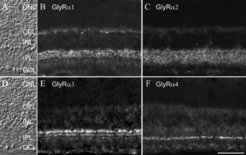
Nach der Freisetzung an der Synapse diffundiert der Neurotransmitter Glyzin zur nachgeschalteten Zelle und bindet an spezielle Moleküle in deren Membran, die so genannten Transmitterrezeptoren. Der Glyzinrezeptor (GlyR) besteht aus zwei α- und drei β-Untereinheiten, die zusammen einen Chloridkanal bilden. Durch die Bindung von Glyzin öffnet sich der Kanal und Chlorid strömt in die Zelle ein, wodurch diese gehemmt wird. Vier Gene für die α-Untereinheiten (α1, α2, α3, α4) und ein Gen für die β-Untereinheit sind bekannt. Nach den Regeln der Kombinatorik lassen sich daraus insgesamt 10 unterschiedliche Rezeptorkomplexe bilden. Daher wurde untersucht, wie sich diese Rezeptorkomplexe in der Netzhaut verteilen. Dazu wurden Gewebeschnitte der Netzhaut mit Hilfe von Antikörpern angefärbt, die spezifische Untereinheiten des GlyRs erkennen (Abb. 2). Am Fluoreszenzmikroskop sieht man eine punktförmige Verteilung der Rezeptoren, und es konnte durch elektronenmikroskopische Untersuchungen nachgewiesen werden, dass diese Punkte einer Aggregation der Rezeptoren an den Synapsen entsprechen. Die vier α- Untereinheiten des GlyRs sind offensichtlich an unterschiedlichen Synapsen in der Netzhaut exprimiert, denn ihre Verteilung erscheint deutlich verschieden. Es wurden auch Doppelfärbungen mit zwei Antikörpern durchgeführt, die zeigen, dass in der Regel an einer Synapse nur eine der vier α-Untereinheiten vorkommt [2]. Dies bedeutet, dass es mindestens vier unterschiedliche Isoformen von Glyzinrezeptoren in der Netzhaut gibt. Dadurch stellte sich die interessante Frage, wodurch festgelegt wird, welche Isoform eines GlyRs von einer bestimmten Nervenzelle exprimiert wird: Beeinflusst die postsynaptische Zelle selbst die Isoform, oder aber legen die oben beschriebenen unterschiedlichen Typen glyzinerger Amakrinzellen, also die präsynaptischen Zellen, die Expression der individuellen α Untereinheit fest?
Physiologische Untersuchungen der Glyzinrezeptoren in der Netzhaut
Wird einer eingeschläferten Maus die Netzhaut entnommen, bleibt sie als Organpräparat ca. acht Stunden lang funktionsfähig. Es werden 0,2 mm dicke Schnitte (slices) der Netzhaut hergestellt und in einer Gewebekulturkammer auf einen Mikroskoptisch platziert. Mit feinsten Glaskapillaren (Mikroelektroden) können die elektrischen Signale unterschiedlicher Nervenzellen in der Netzhaut gemessen werden.
Zur Untersuchung der Glyzinrezeptoren wurden Signale gemessen, die bei Überspülung des Netzhautschnittes mit Glyzin hervorgerufen werden können. Dabei zeigte sich, dass bei allen Nervenzellen der inneren Netzhaut (Bipolar-, Amakrin- und Ganglienzellen) ein Einstrom von Chloridionen ausgelöst werden kann, was darauf hinweist, dass alle diese Zellen Glyzinrezeptoren besitzen. Anschließend wurden bei den gleichen Zellen spontane postsynaptische Ströme gemessen, die durch die interne Freisetzung von Glyzin an Synapsen entstehen (so genannte sIPSCs). Solche spontanen Ströme entstehen immer dann, wenn ein synaptisches, mit Glyzin gefülltes Bläschen (Vesikel) freigesetzt wird und das darin enthaltene Glyzin nachfolgend an die postsynaptischen Rezeptoren bindet. Der Zeitverlauf dieser sIPSCs stellte sich als charakteristisch für die unterschiedlichen Isoformen der Glyzinrezeptoren heraus: Liegt die α1-Untereinheit an der Synapse vor, klingen die sIPSCs innerhalb von 5 Millisekunden ab, ist die α2-Untereinheit eingebaut, beträgt die Abklingzeit 10 bis 20 Millisekunden. Die Analyse der Abklingzeiten lässt also erkennen, welche Glyzinrezeptoren vorhanden sind.
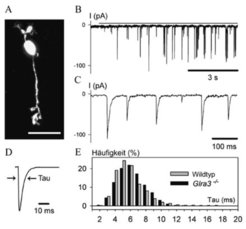
Die Messungen an Stäbchen-Bipolarzellen sind in Abbildung 3 zusammenfasst. Abbildung 3A zeigt eine Bipolarzelle, die während der Messungen mit einem fluoreszierenden Farbstoff gefüllt wude. Die Registrierung der spontanen Ströme ist bei niedriger Zeitauflösung in Abbildung 3B und bei hoher Auflösung in Abbildung 3C zu sehen. Der gemittelte sIPSC einer Stäbchenbipolarzelle (Abb. 3D) lässt den Zeitverlauf der IPSCs deutlich erkennen, und die Abklingzeitkonstante Tau (τ) liegt bei 6,1 Millisekunden. Eine typische Verteilung der Zeitkonstanten von insgesamt 26 Stäbchenbipolarzellen ist in Abbildung 3E gezeigt. Der Mittelwert liegt bei τ = 5,5 Millisekunden, was dafür spricht, dass die α1- Untereinheit des GlyRs an den Synapsen eingebaut und dadurch eine sehr schnelle synaptische Übertragung gewährleistet ist.
Die gleichen Untersuchungen wurden auch mit transgenen Mäusen durchgeführt, bei denen keine α1-Untereinheit vorliegt (Glra1spd-ot-Mäuse). In Netzhautschnitten dieser Tiere konnten bei Bipolarzellen keine synaptischen Ströme gemessen werden, und auch die Überspülung der Schnitte mit Glyzin löste keine Ströme aus. Dies beweist, dass nur die α1 zusammen mit der β-Untereinheit in den GlyRs in den Bipolarzellen vorliegt. Wurden analog die Untersuchungen mit einer transgenen Mauslinie durchgeführt, bei der die α3 Untereinheit fehlte (Glra3-/--Maus), wurde zwischen Mutante und Wildtyp-Maus kein Unterschied gefunden (Abb. 3E; [3]).
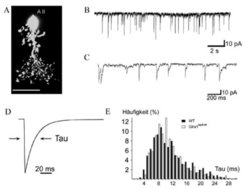
Die spontanen synaptischen Ströme, die bei Amakrinzellen gemessen werden, sind im Vergleich zu denen der Bipolarzellen langsam. Eine Typ-AII-Zelle, die während der Messung mit einem fluoreszierenden Farbstoff gefüllt wurde, ist in Abbildung 4A zu sehen. Die Registrierungen der spontanen Ströme bei niedriger Zeitauflösung bzw. hoher Zeitauflösung sind in Abbildung 4B und C gezeigt und der gemittelte spontane Strom dieser AII-Zelle ist in Abbildung 4D dargestellt. Die Abklingzeitkonstante τ dieser Zelle betrug 20 Millisekunden. Die Häufigkeit der Zeitkonstanten von insgesamt 11 registrierten AII-Zellen ist in dem Histogramm (Abb. 4E) zu sehen. Die gemittelte Zeitkonstante war 11 Millisekunden. Auch für die AII Amakrinzellen wurden die sIPSCs der Wildtyp-Maus mit denen der Glra1spd-ot und der Glra3-/-Mutanten verglichen. Bei den Glra3-/- Mäusen konnten keine synaptischen Ströme bei AII-Amakrinzellen gemessen werden. Im Gegensatz dazu waren die synaptischen Ströme der Glra1spd-ot Mutanten nicht verschieden von denen der Wildtyp-Mäuse (Abb. 4E). Dieses Ergebnis zeigt, dass die synaptischen Ströme von AII-Amakrinzellen durch Glyzinrezeptoren vermittelt werden, die aus α3- und β-Untereinheiten bestehen.
Neben den AII-Amakrinzellen wurden noch weitere der in Abbildung 1B gezeigten Amakrinzellen untersucht. Dabei stellte sich heraus, dass die meisten Amakrinzellen mit kleinen Dendritenbäumen Glyzinrezeptoren exprimieren, die aus α2- und β-Untereinheiten bestehen (Mittelwert von τ: 27 ms). Bei Ganglienzellen werden ebenfalls, je nach Ganglienzelltyp, unterschiedliche GlyRs exprimiert.
Die in diesem Bericht gezeigten Ergebnisse lassen sich wie folgt zusammenfassen: In der Netzhaut konnten alle bisher bekannten Untereinheiten von Glyzinrezeptoren in postsynaptischen Dichten nachgewiesen werden. Je nach Zellklasse (Bipolar-, Amakrin- oder Ganglienzelle) wurden verschiedene Untereinheiten in den Synapsen gefunden, was dazu führt, dass diese hemmenden glyzinergen Synapsen unterschiedliche Kinetiken zeigten. Derzeit wird untersucht, wie sich dieses Verhalten der hemmenden Synapsen auf die Übertragung der Lichtsignale durch die Netzhaut auswirkt.
Die Untersuchungen der Glyzinrezeptoren sind ein gemeinsames Projekt der Abteilungen für Neuroanatomie und Neurochemie.
![(A) Nervenzellen in der Netzhaut des Auges. Die Photorezeptoren (Zapfen und Stäbchen) sind die eigentlichen Lichtsinneszellen. In der äußeren plexiformen Schicht bilden sie synaptische Kontakte mit den Bipolar- und Horizontalzellen. Bipolarzellen übertragen die Signale in die innere plexiforme Schicht und gehen synaptische Verbindungen mit Ganglienzellen und Amakrinzellen ein. Die Nervenfasern (Axone) der Ganglienzellen bilden den optischen Nerv, der das Auge mit dem Gehirn verbindet. (B) Vier Amakrinzellen aus der Netzhaut der Maus. Sie sind durch grün-fluoreszierendes Protein (GFP) markiert, das über eine Genveränderung in die Zellen eingebracht wurde. Im Hintergrund sind andere Amakrinzellen immunhistochemisch mit Antikörpern gegen Calbindin angefärbt [2]. (A) Nervenzellen in der Netzhaut des Auges. Die Photorezeptoren (Zapfen und Stäbchen) sind die eigentlichen Lichtsinneszellen. In der äußeren plexifor](https://www.mpg.de/391138/zoom-1293749295.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzkxMTM4fQ%3D%3D--69543fe608104fa09993e58b81d2f152e09f3cb0)

![Elektrophysiologische Charakterisierung der Glyzinrezeptoren einer Stäbchenbipolarzelle.
(A) Stäbchenbipolarzelle, die durch die Mikroelektrode mit einem Fluoreszenzfarbstoff gefüllt wurde (Skala: 25 µm). (B) Spontane, hemmende postsynaptische Ströme (sIPSCs), wie sie von der in A gezeigten Zelle registriert wurden. (C) Die gleichen Ströme wie in B, jedoch mit höherer zeitlicher Auflösung dargestellt. (D) Gemittelter und normierter Strompuls. Einem schnellen Anstieg folgt ein exponentiell verlaufender Abstieg, der durch eine Zeitkonstante (Tau) beschrieben wird. (E) Häufigkeit der Zeitkonstanten, die bei einzelnen spontanen, postsynaptischen Strompulsen gemessen werden. Die grauen Balken zeigen Messungen bei Wildtyp-Mäusen, die schwarzen Balken zeigen Messungen mit einer Mutante, bei der die Glyzinrezeptor α3- Untereinheit fehlte. Die beiden Verteilungen zeigen keine signifikanten Unterschiede [3]. Elektrophysiologische Charakterisierung der Glyzinrezeptoren einer Stäbchenbipolarzelle.
(A) Stäbchenbipolarzelle, die durch die Mikroelektrode mit ei](https://www.mpg.de/391250/zoom-1293749805.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzkxMjUwfQ%3D%3D--abe799418c147ecf3d5fab5c4121a374a327c80a)
